|
Составление уравнений окислительновосстано-вительных реакций
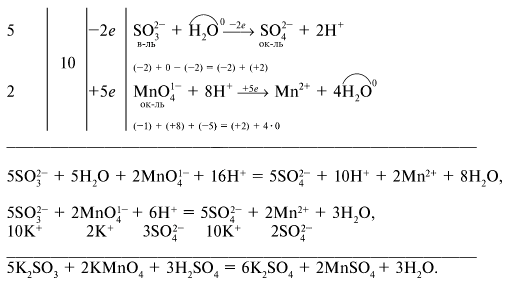
1) Метод электронного баланса основан на подсчете числа электронов, отдаваемых и принимаемых атомами, меняющими степень окисления.
FeS2 + HN03(конц.)-------- > Fe(NO3)3 + H2S04 + NO + Н20.
Число отданных атомов должно быть равно числу принятых:
5 молекул HNOg идут на окисление FeS2, и еще 3 молекулы HNO3 необходимы для образования Fe(NO3)3:
FeS2 + 8НNO3(концю) = = Fe(N03)3 + 2H2S04 + 5NO + 2H20.
2) В методе электронно-ионного баланса (метода полуреакций) рассматривают переход электронов от одних атомов или ионов к другим с учетом характера среды. Сильные электролиты записывают в виде ионов, слабые электролиты или нерастворимые вещества — в молекулярной форме. Для уравнивания числа атомов водорода и кислорода используют молекулы Н20 и ионы Н+ (в кислой среде) или ОН-(в щелочной среде):
FeS2 + 5N03 + 4H+ = Fe3+ + 2H2S04 + 5NO + 2H20
FeS2 + 8HN03(конц.) = Fe(NO3)3 + 2H2S04 + 5N0 + 2H20.
|
